- 28/03/2023
Lựa chọn và sử dụng kháng sinh trong điều trị Staphylococcus aureus
Staphylococcus aureus là vi khuẩn thường trú trên da và niêm mạc của người bình thường nhưng cũng có thể là nguyên nhân gây ra các bệnh nhiễm khuẩn từ nhiễm khuẩn da, mô mềm đến nhiễm khuẩn xâm lấn.1 Việc sử dụng kháng sinh không hợp lý trong điều trị đã làm phát sinh thêm các chủng S.aureus đề kháng kháng sinh.
Một số chủng S.aureus trên lâm sàng:
- S.aureus nhạy cảm methicillin (MSSA): MICoxacillin <= 2 mg/mL hoặc MICcefoxitin <= 4 mg/mL
- S.aureus đề kháng methicillin (MRSA): MICoxacillin >= 4 mg/mL hoặc MICcefoxitin >= 8 mg/mL
+ MRSA liên quan chăm sóc y tế (Healthcare-associated MRSA, HA-MRSA): HA-MRSA thường liên quan đến các bệnh nhiễm khuẩn xâm lấn nghiêm trọng như nhiễm khuẩn da mô mềm, nhiễm khuẩn huyết, viêm phổi…
+ MRSA liên quan cộng đồng (Community-associated MRSA, CA-MRSA): CA-MRSA thường gây ra nhiễm khuẩn da và mô mềm ở người khỏe mạnh trong cộng đồng. Bên cạnh đó, các chủng CA-MRSA thường mang gen tạo ra độc tố Panton-Valentin leukocidin dẫn đến sự phá hủy bạch cầu và tổn gây hoại tử mô (tổn thương da hoại tử, viêm phổi hoại tử…)
- S.aureus nhạy cảm vancomycin (VSSA): MICvancomycin <= 2 mg/mL
- S.aureus trung gian vancomycin (VISA): MICvancomycin từ 4-8 mg/mL
- VISA dị kháng (hVISA) là quần thể vi khuẩn có sự hiện diện của một của một nhóm nhỏ vi khuẩn có MICvancomycin ở mức trung gian, trong khi toàn bộ quần thể vi khuẩn vẫn còn nhạy cảm với vancomycin. Một số báo cáo cho là hVISA có thể là nguyên nhân dẫn đến thất bại điều trị với vancomycin.
- S.aureus kháng vancomycin (VRSA): MICvancomycin >=16 mg/mL
* Các ngưỡng MIC xác định sự đề kháng kháng sinh được tham khảo theo CLSI.
Các kháng sinh có phổ trên tụ cầu
Đa số các kháng sinh hiện nay được sử dụng trên lâm sàng đều có phổ trên MSSA, tuy nhiên các beta-lactam kháng tụ cầu (ASBL) vẫn được ưu tiên trong điều trị MSSA do một số ưu điểm. Ngược lại, rất ít kháng sinh có phổ trên MRSA. Do đó, sử dụng kháng sinh một cách hợp lý giữ vai trò rất quan trọng trong điều trị và phòng ngừa đề kháng kháng sinh.
Điều trị MSSA
Như đã đề cập ở trên, ASBL (nafcillin, oxacillin, cefazolin…) là những thuốc được ưu tiên trong điều trị nhiễm khuẩn MSSA do kinh nghiệm sử dụng lâu đời, hoạt tính mạnh trên MSSA, tiết kiệm chi phí, tránh gây rối loạn hệ vi sinh vật có lợi, bảo tồn hoạt tính các kháng sinh phổ rộng – hạn chế đề kháng thuốc…
Tuy nhiên trong trường hợp các ASBL không có sẵn, các kháng sinh beta-lactam khác vẫn có thể được cân nhắc sử dụng trong điều trị.
Ampicillin-sulbactam: tại Nhật Bản năm 2019, do tình trạng thiếu hụt cefazolin, ampicillin-sulbactam đã được đưa vào sử dụng trong điều trị nhiễm khuẩn huyết do MSSA sản xuất beta-lactamase. Một nghiên cứu hồi cứu đơn trung tâm trên 71 người bệnh đã được thực hiện để đánh giá hiệu quả của ampicillin-sulbactam so với cefazolin.2 Kết quả cho thấy không có sự khác biệt về tỷ lệ tử vong trong vòng 90 ngày giữa 2 nhóm (HR: 1,02, 95% CI, 0,227 đến 4,53). Tuy nhiên, ở nhóm sử dụng ampicillin-sulbactam, người bệnh có nguy cơ rối loạn chức năng gan cao hơn.
Ceftriaxon: mặc dù một số nghiên cứu trước đây cho thấy rằng ceftriaxon có tỷ lệ thất bại điều trị cao hơn so với cefazolin trong điều trị nhiễm khuẩn huyết do MSSA.3,4 Điều này có thể là do hoạt tính của ceftriaxon trên MSSA thấp hơn so với các ASBL. Tuy nhiên, một bài tổng quan hệ thống bao gồm 7 nghiên cứu hồi cứu trên tổng cộng 1640 người bệnh năm 2021 cho thấy rằng:5 không có sự khác biệt về tỷ lệ tử vong trong vòng 90 ngày (RR 0,93, 95% CI, 0,46 đến 1,88), tái nhập viện (RR 0,96, 95% CI, 0,57 đến 1,64) và tái phát nhiễm khuẩn (RR 1,04, 95% CI 0,63 đến 1,72) giữa 2 nhóm (ceftriaxon so với ASBL). Ngoài ra, ceftriaxon có nguy cơ độc tính thấp hơn (RR 0,49, 95% CI, 0,27 đến 0,88).
Piperacillin-tazobactam: một nghiên cứu hồi cứu trên 428 người bệnh nhiễm khuẩn huyết MSSA (nafcillin hoặc oxacillin, n = 105; cefazolin, n = 107; piperacillin-tazobactam, n = 113; flouroquinolon, n = 103) được công bố vào năm 2019 đã cho thấy rằng tỷ lệ tử vong thấp hơn đáng kể trong nhóm được điều trị bằng ASBL so với piperacillin – tazobactam (HR, 0,10, 95% CI, 0,01 đến 0,78).6 Do đó, dựa vào nghiên cứu này piperacillin-tazobactam có thể không phải là một kháng sinh hiệu quả trong điều trị nhiễm khuẩn huyết do MSSA.
Clindamycin cũng là một lựa chọn thích hợp để điều trị nhiễm khuẩn MSSA. Sinh khả dụng đường uống của clindamycin cao thích hợp cho việc sử dụng kháng sinh qua đường tiêu hóa. Sau khi được sử dụng, thuốc phân bố tốt vào mô, xương. Ngoài ra, thuốc còn được vận chuyển tích cực vào bạch cầu đa nhân và đại thực bào nên có thể xâm nhập tốt vào các ổ áp-xe. Bên cạnh đó, clindamycin còn ức chế sản xuất ngoại độc tố của tụ cầu có liên quan đến hội chứng sốc nhiễm độc (toxic shock syndrome). Tác dụng phụ phổ biến nhất của clindamycin là gây viêm đại tràng giả mạc do Clostridioides difficile nên cần lưu ý trong quá trình sử dụng.
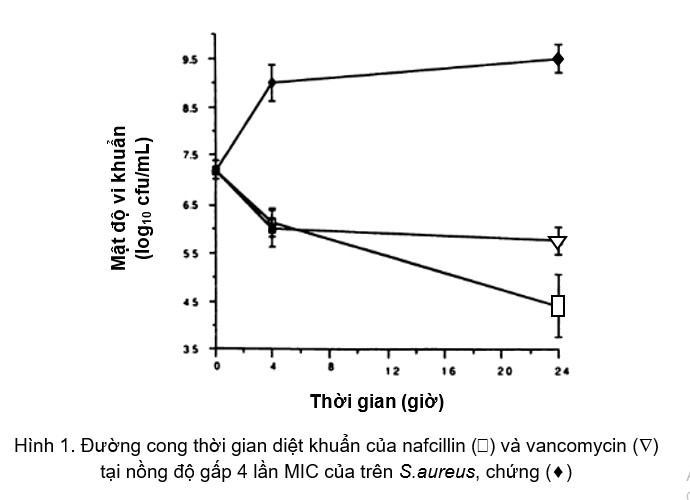
Vancomycin không được ưu tiên trong điều trị MSSA do có tác dụng diệt khuẩn chậm và yếu hơn ASBL (hình 1). Năm 2015, một nghiên cứu hồi cứu so sánh hiệu quả giữa beta-lactam và vancomycin trong điều trị nhiễm khuẩn huyết MSSA đã được thực hiện trên 122 bệnh viện.7 Kết quả của nghiên cứu cho thấy những người bệnh được điều trị dứt điểm bằng beta-lactam có tỷ lệ tử vong thấp hơn 35% so với những người bệnh được điều trị bằng vancomcyin, đặc biệt là các ASBL. Do đó, việc sử dụng vancomycin trong điều trị MSSA chỉ nên được cân nhắc khi người bệnh không dung nạp được các kháng sinh beta-lactam.
Điều trị MRSA
Vancomycin
Vancomycin là kháng sinh thuộc nhóm glycopeptid được dùng để điều trị cho người bệnh nghi ngờ hoặc nhiễm khuẩn vi khuẩn Gram (+) xâm lấn, bao gồm cả MRSA. Khoảng trị liệu của vancomycin tương đối hẹp. Do đó, để đảm bảo hiệu quả và giảm độc tính, hướng dẫn đồng thuận năm 20208 đã nêu ra những lưu ý trong việc sử dụng vancomycin để điều trị nhiễm khuẩn nặng MRSA:
- Theo dõi nồng độ thuốc dựa trên nồng độ đáy 15 – 20 mg/L không còn được khuyến cáo do không đủ bằng chứng về hiệu quả và an toàn. Việc chỉnh liều cần phải dựa trên giá trị AUC/MIC từ 400 – 600 (giả định MICvancomycin = 1 mg/L). Khi MICvancomycin > 1 mg/L, liều thông thường không đạt được AUC/MIC mục tiêu, liều cao hơn có thể gây ra độc tính, nên dựa vào đánh giá lâm sàng để thay đổi liệu pháp. MICvancomycin < 1 mg/L, không khuyến cáo giảm liều để đạt AUC/MIC mục tiêu.
- Truyền liên tục được khuyến cáo với những ưu điểm: đạt được mục tiêu sớm, nồng độ thuốc trong huyết thanh ổn định, dễ theo dõi hơn và giảm nguy cơ độc tính trên thận. Cần cân nhắc chế độ truyền liên tục khi truyền ngắt quãng không thể đạt được AUC mục tiêu.
- Do khả năng phân bố vào mô của vancomycin rất hạn chế. Do đó, ở những người bệnh nặng, để nhanh chống đạt được nồng độ mục tiêu, liều nạp có thể được cân nhắc. Việc không dùng liều nạp có thể dẫn đến không đạt được đáp ứng lâm sàng sớm.
Bên cạnh đó, do tác dụng diệt khuẩn chậm của vancomycin nên cần vài ngày để có đáp ứng lâm sàng. Hầu hết các chuyên gia đồng ý rằng nên đánh giá và thay đổi liệu pháp khi tình trạng nhiễm khuẩn huyết dai dẳng diễn ra ở ngày thứ ngày thứ 7 sau khi điều trị. Hơn nữa, xác định giá trị MIC của vi khuẩn cũng giữ vai trò quan trọng trong việc dự đoán hiệu quả của vancomycin khi bắt đầu điều trị.
Teicoplanin
Teicoplanin là kháng sinh nhóm glycopeptid có phổ tác động tương tự vancomycin. Các nghiên cứu đã chứng minh teicoplanin có hiệu quả tương tự như vancomycin nhưng có xu hướng dung nạp tốt hơn vancomycin. Một nghiên cứu tổng quan hệ thống được thực hiện năm 2009 so sánh hiệu quả và an toàn của teicoplanin so với vancomycin,9 kết quả cho thấy không có khác biệt có ý nghĩa về thất bại lâm sàng (RR, 0,92; 95% CI, 0,81 đến 1,05) và thất bại vi sinh (RR, 1,24; 95% CI, 0,93 đến 1,65) giữa 2 nhóm. Bên cạnh đó, tỷ lệ gặp phải tác dụng không mong muốn, độc tính trên thận, hội chứng người đỏ ở teicoplanin là thấp hơn.
Tuy nhiên, có sự đề kháng chéo giữa vancomycin và teicoplanin, nên teicoplanin thường không được sử dụng thay thế cho vancomycin trên những người bệnh thất bại điều trị với vancomycin trước đó. Teicoplanin có thể được sử dụng thay thế cho vancomycin ở những người bệnh không dung nạp với vancomycin. Việc sử dụng liều nạp và TDM đối với teicoplanin cũng được khuyến cáo. Đồng thuận năm 2022 về hướng dẫn thực hành lâm sàng cho việc theo dõi nồng độ teicoplanin10 đã đưa ra những khuyến cáo về chế độ liều và TDM, tóm tắt một số điểm cần lưu ý:
- AUC/MIC là thông số PK/PD chính của teicoplanin, tuy nhiên do chưa có sẵn phần mềm ước tính AUC nên nồng độ đáy được khuyến cáo làm chỉ số thay thế.
- Thời điểm TDM nên thực hiện vào ngày thứ tư (nồng độ đáy) để đánh giá hiệu quả của liều nạp trong 3 ngày đầu tiên, TDM tiếp theo để đánh giá hiệu quả của liều duy trì, nên được thực hiện sau lần đầu tiên 7 ngày ở những người rối loạn chức năng thận hoặc nhiễm trùng nghiêm trọng cần đạt nồng độ mục tiêu vượt quá 20 mg/L.
- Nồng độ đáy mục tiêu được khuyến cáo là 15 – 30 mg/L ở người bệnh nhiễm khuẩn MRSA không biến chứng và có chức năng thận bình thường hoặc suy giảm. Đối với nhiễm trùng MRSA nghiêm trọng có biến chứng (viêm nội tâm mạc, viêm tủy xương…) nồng độ đáy mục tiêu được đề xuất là 20 – 40 mg/L.
- Chế độ liều nạp được khuyến cáo sử dụng trong 3 ngày đầu tiên (4 – 5 liều) để nhanh chóng đạt nồng độ mục tiêu trong điều trị.
Linezolid
Linezolid là kháng sinh thuộc nhóm oxazolidinon có hoạt tính kiềm khuẩn chống lại các vi khuẩn Gram (+). Khác với vancomycin, linezolid không có phổ trên C.difficile nên kháng sinh này có thể gây ra tình trạng viêm đại tràng giả mạc do C.difficile. Bên cạnh đó, một số tác dụng phụ khác góp phần hạn chế việc sử dụng linezolid để điều trị các bệnh nhiễm trùng lâu dài bao gồm:11
- Nhiễm acid lactic có thể gây đe dọa tính mạng với tỷ lệ mắc 6,8%, yếu tố nguy cơ bao gồm: tuổi >= 60, điều trị dài ngày >= 28 ngày, Cmin (trough) > 2 mg/L khi dùng trong thời gian dài.
- Suy tủy (giảm tiểu cầu và thiếu máu) thường mất 1 đến 2 tuần để hồi phục sau khi ngưng điều trị, các yếu tố nguy cơ bao gồm: suy giảm chức năng thận (CrCl < 60 mL/phút), điều trị kéo dài > 14 ngày, số lượng tiểu cầu ban đầu <= 200 x 109 /L…
- Bệnh lý thần kinh ngoại biên (đau, tê, dị cảm…), thần kinh thị giác (giảm thị lực, nhạy cảm với ánh sáng) có thể xảy ra khi điều trị hơn 28 ngày, các yếu tố nguy cơ bao gồm Cmin (trough) > 2 mg/L khi dùng trong thời gian dài và điều trị kéo dài > 28 ngày
- Linezolid cũng có thể gây ra hội chứng serotonin khi dùng chung với các thuốc ức chế chuyển hóa linezolid hoặc các thuốc làm tăng nồng độ serotonin trong cơ thể (vd: dihydroergotamin, (nor)adrenalin, L – Dopa, fentanyl, clozapin, SSRI,…)
Daptomycin là kháng sinh thuộc nhóm lipopeptid có hoạt tính chống lại các vi khuẩn Gram (+) bao gồm MRSA và VRE. Tuy nhiên, daptomycin phân bố vào mô phổi kém và bị bất hoạt bởi chất diện hoạt (surfactant) nên không được sử dụng trong viêm phổi.
Flouroquinolon có thể có hoạt tính chống lại các chủng CA-MRSA, nhưng chúng không được khuyến cáo sử dụng thường xuyên trong điều trị viêm phổi bởi vì đề kháng có thê xuất hiện khi dùng đơn trị.12
Một số lưu ý trong lựa chọn kháng sinh
Bài viết chỉ đề cập đến lựa chọn kháng sinh trong điều trị viêm phổi, nhiễm khuẩn huyết. Đây là những bệnh lý thường gặp tại Bệnh viện Phạm Ngọc Thạch. Những nhiễm khuẩn khác sẽ không được đề cập đến trong bài.
Viêm phổi
Theo hướng dẫn của IDSA năm 2011 trong điều trị nhiễm trùng MRSA,12 các kháng sinh được khuyến cáo trong điều trị viêm phổi do MRSA bao gồm vancomycin, linezolid và clindamycin. Thất bại trong việc sử dụng vancomycin để điều trị viêm phổi có thể là do khả năng thấm vào mô phổi kém, điều này nhấn mạnh vai trò quan trọng của liều nạp cũng như TDM để đảm bảo nồng độ thuốc đạt mục tiêu trị liệu. Ngược lại, linezolid có khả năng xâm nhập vào mô tốt hơn, nên linezolid đã từng được xem là một lựa chọn thay thế vancomycin trong điều trị viêm phổi. Tuy nhiên, các nghiên cứu trước đó lại cho thấy tỷ lệ khỏi bệnh là tương đương nhau giữa vancomycin và linezolid trong điều trị viêm phổi ở người lớn.
Năm 2013, trong một phân tích gộp bao gồm 9 thử nghiệm ngẫu nhiên với tổng số 4026 người bệnh đã đánh giá hiệu quả và an toàn của vancomycin và linezolid trong điều trị viêm phổi bệnh viện.13 Kết quả cho thấy chênh lệch nguy cơ tử vong tuyệt đối giữa linezolid và vancomycin là 0,01% (95% CI -2.1% đến 2.1%). Tác dụng phụ đường tiêu hóa thường gặp hơn đối với linezolid (RD: 0.8% 95% CI 0% to 1.5%) nhưng không có sự khác biệt về suy thận, giảm tiểu cầu, ngừng thuốc do tác dụng phụ.
Hướng dẫn của ATS/IDSA năm 2016 về quản lý viêm phổi thở máy và viêm phổi bệnh viện ở người lớn14 cũng đề cập về hiệu quả và an toàn tương đương nhau giữa vancomycin và linezolid. Việc lựa chọn vancomycin hay linezolid trong điều trị có thể cân nhắc vào các yếu tổ cụ thể của người bệnh như số lượng tế bào máu, các thuốc dùng đồng thời có khả năng ức chế tái thu hồi serotonin, chức năng thận và chi phí.
Ngoài ra, đã có nghiên cứu báo cáo về các đợt bùng phát S.aureus kháng linezolid.15 Do đó, việc hạn chế sử dụng linezolid và kiểm soát nhiễm khuẩn sẽ giúp giảm sự xuất hiện của các chủng đề kháng. Linezolid thường được sử dụng thay vì vancomycin ở những người bệnh có chức năng thận suy giảm. Tuy nhiên, một tổng quan hệ thống trên 3580 người bệnh đã cho thấy nguy cơ giảm tiểu cầu liên quan đến linezolid tăng cao hơn ở người bệnh có chức năng thận suy giảm.16
Nhiễm khuẩn huyết
Đối với nhiễm khuẩn huyết do MRSA, vancomycin là lựa chọn đầu tay, daptomycin có thể cân nhắc là lựa chọn thay thế.
Trong trường hợp thất bại điều trị với vancomycin, có thể chuyển sang điều trị với daptomycin. Tuy nhiên, việc điều trị với daptomycin cần cân nhắc do vi khuẩn có hiện tượng đề kháng với daptomycin sau khi điều trị thất bại với vancomycin. Trong một nghiên cứu trên 47 mẫu phân lập lâm sàng hVISA/VISA,17 những chủng phân lập hVISA và VISA có tỷ lệ không nhạy cảm với daptomycin lầm lượt là 15% và 38% (phương pháp BMD). Trong khi đó, tỷ lệ không nhạy cảm với daptomyicn trên VSSA là 0%. Bên cạnh đó, daptomycin không nên được lựa chọn để điều trị nhiễm khuẩn huyết có liên quan đến viêm phổi.
Linezolid là một tác nhân khác nên được cân nhắc trong điều trị nhiễm khuẩn huyết do MRSA. Trong một bài phân tích tổng hợp 5 nghiên cứu ngẫu nhiên so sánh hiệu quả của linezolid và vancomycin trong điều trị nhiễm khuẩn huyết MRSA.18 Kết quả cho thấy linezolid không thua kém vancomycin trong điều trị nhiễm khuẩn huyết thứ phát do S.aureus.
Ngoài ra, có một số nghiên cứu ủng hộ việc sử dụng phối hợp vancomycin và các kháng sinh khác trong điều trị MRSA. Tuy nhiên, trong một thử nghiệm ngẫu nhiên có đối chứng trên 352 người bệnh đánh giá hiệu quả của phổi hợp vancomycin hoặc daptomycin với betalactam kháng tụ cầu trong điều trị nhiễm khuẩn huyết MRSA,19 kết quả cho thấy phối hợp thuốc không làm giảm tỷ lệ tử vong nhưng làm tăng độc tính trên thận, đặc biệt là với các penicillin kháng tụ cầu. Hiệu quả của phối hợp vancomycin và beta-lactam khác cũng được đánh giá trong một tổng quan hệ thống trên 806 người bệnh,20 kết quả của nghiên cứu cũng cho thấy việc kết hợp thuốc không làm giảm tỷ lệ tử vong 28/30 ngày. Carbapenem cũng bao gồm trong nghiên cứu này, tuy nhiên do cỡ mẫu nhỏ nên không đủ để đánh giá hiệu quả. Trong thực hành lâm sàng, thường thấy phối hợp giữa carbapenem và vancomycin trong điều trị, tuy nhiên việc sử dụng carbapenem không nhằm mục tiêu điều trị MRSA mà để nhắm đến những vi khuẩn khác như Pseudomonas aeruginosa, vi khuẩn sinh ESBL…
Kết luận
Với tình hình đế kháng đang ngày càng gia tăng, việc sử dụng kháng sinh hợp lý giữ vai trò quan trọng đối với kết cục lâm sàng của người bệnh. Các beta-lactam kháng tụ cầu (nafcillin, oxacillin, cefazolin…) là lựa chọn tốt nhất để điều trị MSSA, trường hợp cơ sở không có các thuốc nêu trên, beta-lactam khác vẫn có thể được sử dụng. Trong điều trị MRSA, tùy đặc điểm người bệnh có thể lựa chọn đơn trị một trong các kháng sinh sau: vancomycin, teicoplanin, linezolid. Nên ưu tiên sử dụng vancomycin trừ trường hợp người bệnh suy thận, quá mẫn hoặc đã kháng vancomycin. Giám sát nồng độ thuốc là yếu tố góp phần tối ưu hóa hiệu quả và giảm thiểu độc tính trong điều trị, đặc biệt trong việc sử dụng vancomycin.
Tài liệu tham khảo
- Foster T. Staphylococcus aureus. Molecular Medical Microbiology. 2002:839-888.
- Hirai J, Asai N, Hagihara M, et al. Comparative Effectiveness of Ampicillin/Sulbactam versus Cefazolin as Targeted Therapy for Bacteremia Caused by Beta-Lactamase-Producing Methicillin-Sensitive Staphylococcus aureus: A Single-Center Retrospective Study. Antibiotics. 2022;11(11):1505.
- Carr DR, Stiefel U, Bonomo RA, Burant CJ, Sims SV. A comparison of cefazolin versus ceftriaxone for the treatment of methicillin-susceptible Staphylococcus aureus bacteremia in a tertiary care VA medical center. Oxford University Press US; 2018:ofy089.
- Paul M, Zemer‐Wassercug N, Talker O, et al. Are all beta‐lactams similarly effective in the treatment of methicillin‐sensitive Staphylococcus aureus bacteraemia? Clinical microbiology infection. 2011;17(10):1581-1586.
- Yetmar ZA, Razi S, Nayfeh T, Gerberi DJ, Mahmood M, Saleh OMA. Ceftriaxone versus antistaphylococcal antibiotics for definitive treatment of methicillin-susceptible Staphylococcus aureus infections: a systematic review and meta-analysis. International Journal of Antimicrobial Agents. 2021:106486.
- Beganovic M, Cusumano JA, Lopes V, LaPlante KL, Caffrey AR. Comparative effectiveness of exclusive exposure to nafcillin or oxacillin, cefazolin, piperacillin/tazobactam, and fluoroquinolones among a national cohort of veterans with methicillin-susceptible Staphylococcus aureus bloodstream infection. Oxford University Press US; 2019:ofz270.
- McDanel JS, Perencevich EN, Diekema DJ, et al. Comparative effectiveness of beta-lactams versus vancomycin for treatment of methicillin-susceptible Staphylococcus aureus bloodstream infections among 122 hospitals. Clinical Infectious Diseases. 2015;61(3):361-367.
- Rybak MJ, Le J, Lodise TP, et al. Therapeutic monitoring of vancomycin for serious methicillin-resistant Staphylococcus aureus infections: a revised consensus guideline and review by the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, the Pediatric Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists. American Journal of Health-System Pharmacy. 2020;77(11):835-864.
- Svetitsky S, Leibovici L, Paul M. Comparative efficacy and safety of vancomycin versus teicoplanin: systematic review and meta-analysis. Antimicrobial agents chemotherapy. 2009;53(10):4069-4079.
- Hanai Y, Takahashi Y, Niwa T, et al. Clinical practice guidelines for therapeutic drug monitoring of teicoplanin: a consensus review by the Japanese Society of Chemotherapy and the Japanese Society of Therapeutic Drug Monitoring. Journal of Antimicrobial Chemotherapy. 2022;77(4):869-879.
- UpToDate. Linezolid: Drug information. Accessed 19 February, 2023. https://www.uptodate.com/contents/linezolid-drug-information
- Liu C, Bayer A, Cosgrove SE, et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children. Clinical infectious diseases. 2011;52(3):e18-e55.
- Kalil AC, Klompas M, Haynatzki G, Rupp ME. Treatment of hospital-acquired pneumonia with linezolid or vancomycin: a systematic review and meta-analysis. BMJ open. 2013;3(10):e003912.
- Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clinical infectious diseases. 2016;63(5):e61-e111.
- García MS, De la Torre MÁ, Morales G, et al. Clinical outbreak of linezolid-resistant Staphylococcus aureus in an intensive care unit. Jama. 2010;303(22):2260-2264.
- Shi, Changcheng, et al. “Effect of renal function on the risk of thrombocytopaenia in patients receiving linezolid therapy: a systematic review and meta‐analysis.” British Journal of Clinical Pharmacology 88.2 (2022): 464-475.
- Kelley PG, Gao W, Ward PB, Howden BP. Daptomycin non-susceptibility in vancomycin-intermediate Staphylococcus aureus (VISA) and heterogeneous-VISA (hVISA): implications for therapy after vancomycin treatment failure. Journal of antimicrobial chemotherapy. 2011;66(5):1057-1060.
- Shorr AF, Kunkel MJ, Kollef M. Linezolid versus vancomycin for Staphylococcus aureus bacteraemia: pooled analysis of randomized studies. Journal of antimicrobial chemotherapy. 2005;56(5):923-929.
- Tong SY, Lye DC, Yahav D, et al. Effect of vancomycin or daptomycin with vs without an antistaphylococcal β-lactam on mortality, bacteremia, relapse, or treatment failure in patients with MRSA bacteremia: a randomized clinical trial. Jama. 2020;323(6):527-537.
- Ye C, Wang Z, Hu Y, et al. Systematic review and meta-analysis of the efficacy and safety of vancomycin combined with β-lactam antibiotics in the treatment of methicillin-resistant Staphylococcus aureus bloodstream infections. Journal of Global Antimicrobial Resistance. 2020;23:303-310.