- 22/06/2023
Lựa chọn kháng sinh điều trị một số chủng vi khuẩn Gram âm không lên men lactose trong nhiễm khuẩn bệnh viện
Stenotrophomonas maltophilia, phức hợp Burkholderia cepacia (Burkholderia cepacia complex), Achromobacter spp. -các vi khuẩn không thường gặp có đặc điểm không lên men lactose- có thể là tác nhân trong nhiễm khuẩn cơ hội gây biến chứng nặng ở người bệnh suy giảm miễn dịch, cần hồi sức tích cực, có tình trạng xơ nang biểu hiện tại phổi. Đây là những vi khuẩn phân bố rộng rãi trong tự nhiên, có sẵn nhiều cơ chế đề kháng nội tại đối với các kháng sinh thông dụng hiện nay.[1] Đặc biệt, tỉ lệ đề kháng kháng sinh của các chủng vi khuẩn này trên mẫu bệnh phẩm của người bệnh nằm dài ngày tại bệnh viện được đánh giá cao hơn hẳn so với nguồn nhiễm khuẩn xuất phát từ cộng đồng,[2] vì thế việc điều trị nhiễm khuẩn gây ra bởi các chủng vi khuẩn trên đặt ra nhiều thách thức lên công tác chăm sóc y tế. Bài thông tin thuốc của Tổ Dược Lâm Sàng – Khoa Dược kỳ này xin cung cấp góc nhìn tổng quan về các lựa chọn kháng sinh điều trị được khuyến cáo cho cụ thể từng loại vi khuẩn này trong nhiễm khuẩn bệnh viện.
Stenotrophomonas maltophilia
Stenotrophomonas maltophilia là vi khuẩn Gram âm hiếu khí, dương tính với men catalase, âm tính với men oxidase, lần đầu tiên được phân lập ở người từ một mẫu dịch màng phổi vào năm 1943. S. maltophilia tồn tại và phát triển mạnh trong môi trường ẩm ướt, vì thế chủng này thường được phân lập từ máy phun khí dung, mẫu dịch thẩm tách, ống nội khí quản, máy thở cơ học. Các yếu tố nguy cơ có thể dẫn đến nhiễm S. maltophilia bao gồm bệnh lý ác tính, giảm bạch cầu trung tính kéo dài, xơ nang, có sử dụng kháng sinh phổ rộng gần đây (đặc biệt là nhóm carbapenem), corticosteroid hoặc thuốc ức chế miễn dịch. Từ năm 1995 đến năm 2010, tỷ lệ nhiễm S. maltophilia trên toàn thế giới trong số các vi khuẩn Gram âm không lên men lactose đã tăng từ 6,7% lên 9,1%, đặc biệt là trong nhiễm khuẩn huyết và đường hô hấp. [1-2]
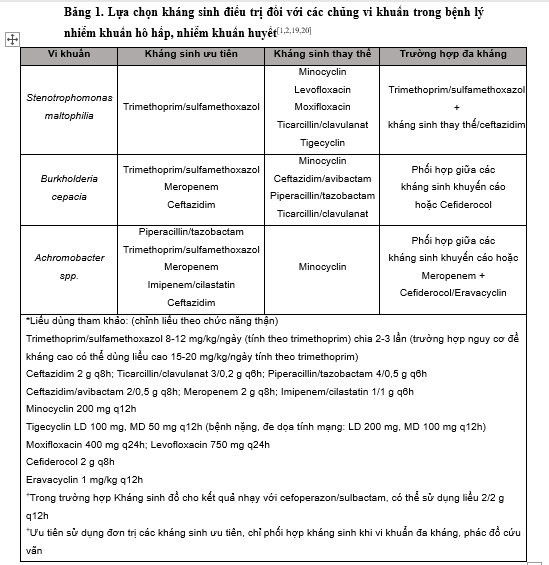
Dựa vào tỷ lệ nhạy cảm cao trên in vitro, trimethoprim/sulfamethoxazol là lựa chọn điều trị đầu tay đối với nhiễm khuẩn do S. maltophilia. Các lựa chọn điều trị khác như levofloxacin, minocyclin hoặc tigecyclin đơn trị có thể được cân nhắc khi gặp tình trạng người bệnh không dung nạp trimethoprim/sulfamethoxazol, suy tủy, độc thận (Bảng 1). Thời gian điều trị viêm phổi do S. maltophilia được khuyến cáo kéo dài 7-14 ngày. Cân nhắc không nên sử dụng cefoperazon/sulbactam theo kinh nghiệm vì tỉ lệ đề kháng cao hơn so với các kháng sinh được khuyến cáo dựa theo một nghiên cứu tại Trung Quốc năm 2019. IDSA (Hiệp hội các bệnh truyền nhiễm Hoa Kỳ) năm 2022 cũng không khuyến cáo sử dụng ceftazidim vì S. maltophilia tiết các men β-lactamase gây đề kháng nội tại; tuy nhiên ceftazidim có thể được áp dụng trong phác đồ phối hợp cùng trimethoprim/sulfamethoxazol với tỉ lệ đáp ứng lâm sàng trên 50% đối với các trường hợp đơn trị không mang lại hiệu quả. [3-9]
Burkholderia cepacia
Các loài phức hợp Burkholderia cepacia (BCC) là vi khuẩn Gram âm hiếu khí, dương tính với men catalase và oxidase. Đặc biệt, B. cepacia là chủng thuộc BCC phổ biến nhất. Những tác nhân gây bệnh này có liên quan đến sự suy giảm nhanh chức năng phổi, tăng tỷ lệ tử vong và “hội chứng cepacia”, có biểu hiện như sốt, viêm phổi hoại tử tiến triển nhanh và nhiễm khuẩn huyết. Các thiết bị y tế bị tạp nhiễm là nguồn lây truyền BCC chủ yếu, chiếm hơn một nửa số ca được thống kê. [1,2] Đặc biệt lưu ý trường hợp dương tính giả liên quan đến việc lấy mẫu máu không đúng kỹ thuật (ví dụ: sát khuẩn vùng da chưa khô đã thực hiện tiêm lấy máu, đầu kim không đảm bảo vô khuẩn, sử dụng lại hộp bông gòn đã dùng…), gây tạp nhiễm vào chai cấy máu; vì thế cần đảm bảo kết quả dương tính ở cả hai chai cấy máu được lấy từ hai vị trí khác nhau kèm kết hợp đánh giá lâm sàng để khẳng định việc nhiễm khuẩn BCC.
Việc điều trị BCC chủ yếu dựa trên dữ liệu in vitro và cá thể hóa theo từng người bệnh căn cứ vào kết quả kháng sinh đồ thể hiện tính nhạy cảm. Trong đó, trimethoprim/sulfamethoxazol, meropenem và ceftazidim là các kháng sinh ưu tiên trong điều trị kinh nghiệm. Thời gian điều trị gồm hai giai đoạn: giai đoạn tấn công kéo dài 14-21 ngày, sau đó là giai đoạn duy trì có thể kéo dài tối đa 12 tháng để đảm bảo sạch khuẩn và giảm nguy cơ xảy ra các đợt cấp viêm phổi (Bảng 1). Các lựa chọn thay thế bao gồm minocyclin, cefoperazon/sulbactam và ceftazidim/avibactam, tuy nhiên các kháng sinh này chỉ dựa theo các thử nghiệm in vitro trên các bệnh phẩm lâm sàng nhiễm khuẩn hô hấp và nhiễm khuẩn huyết với cỡ mẫu nhỏ, chưa được khẳng định rộng rãi về vai trò trong thực hành thường quy. Trong đó, theo một nghiên cứu về báo cáo ca lâm sàng nhiễm khuẩn huyết trên bệnh nhân nhi, việc sử dụng ceftazidim/avibactam chỉ nên được áp dụng trong trường hợp nhiễm BCC dai dẳng, không đáp ứng với các kháng sinh khác. Ngoài ra, các kháng sinh nhóm quinolon không được khuyến cáo sử dụng vì cơ chế đề kháng nội tại của vi khuẩn theo báo cáo của EUCAST (Ủy ban châu Âu về thử nghiệm tính nhạy cảm với kháng sinh). Sự phối hợp giữa trimethoprim/sulfamethoxazol và các kháng sinh β-lactam còn nhạy cảm có thể được áp dụng đối với nhiễm khuẩn huyết hoặc có tình trạng xơ nang tại phổi khi xác định vi khuẩn đa kháng, trong đó, nhiều nghiên cứu đề cao vai trò của phác đồ phối hợp có meropenem khi cho thấy hiệu quả trên thực tế lâm sàng. [1,2,10-14]
Achromobacter spp.
Đây là họ vi khuẩn Gram âm, di động, dương tính với men oxidase và catalase. Vi khuẩn này hiếm khi gây nhiễm khuẩn nặng, nhưng lại có nguy cơ trở thành mầm bệnh cơ hội ở trẻ sơ sinh và người bệnh gặp tình trạng ức chế miễn dịch như xơ nang, bệnh ác tính và suy thận. Achromobacter spp. phát triển mạnh trong môi trường nước và trong các trường hợp nhiễm khuẩn huyết bắt nguồn từ tạp nhiễm do tiêm tĩnh mạch và dịch chạy thận nhân tạo, vì thế hoàn toàn có khả năng tạo ra các đợt lây nhiễm bùng phát trong bệnh viện khi không đảm bảo các biện pháp kiểm soát nhiễm khuẩn từ ca được phân lập vi khuẩn đầu tiên. A. xylosoxidans và A. faecalis được phân lập từ các bệnh phẩm ở tai, mắt, đường tiết niệu, bụng, phổi, hệ thần kinh trung ương và máu, phổ biến nhất là do ống thông nội mạch bị tạp nhiễm. A. xylosoxidans ở người bệnh xơ nang có liên quan đến sự suy giảm chức năng phổi và nguy cơ làm trầm trọng thêm bệnh phổi. [1,2]
Dựa theo tính nhạy cảm trên in vitro của Achromobacter spp., các khuyến cáo đề xuất việc sử dụng piperacillin/tazobactam, carbapenem, ceftazidim hoặc trimethoprim/sulfamethoxazol cho các lựa chọn điều trị đầu tay với thời gian sử dụng khoảng 4-6 tuần trong trường hợp viêm phổi và nhiễm khuẩn huyết (Bảng 1). Ticarcillin/clavulanat và cefoperazon/sulbactam chỉ thể hiện độ nhạy cao trên in vitro với A. xylosoxidans trên mẫu bệnh phẩm đường hô hấp ở một vài biến thể; do đó các khuyến cáo tổng quan không đề xuất việc sử dụng rộng rãi các kháng sinh này. Cefiderocol và eravacyclin là hai kháng sinh thế hệ mới đạt độ nhạy cao trên in vitro, đã được sử dụng trong phác đồ phối hợp với meropenem; dù vậy, FDA (Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ) có cảnh báo sự gia tăng tỉ lệ tử vong khi sử dụng hai kháng sinh này trong điều trị viêm phổi bệnh viện gây ra bởi vi khuẩn Gram âm kháng carbapenem. Gần đây, nghiên cứu tại Mỹ chứng minh vai trò của azithromycin trong việc hiệp đồng tác dụng trên các chủng A. xylosoxidans sinh biofilm (mặc dù đơn trị không có hoạt tính diệt khuẩn), điều này mở ra một hướng điều trị mới trong tình hình vi khuẩn phát triển khả năng kháng thuốc rộng rãi như hiện nay. [1,2,15-18]
Kết luận: Việc sử dụng kháng sinh điều trị các chủng vi khuẩn Gram âm hiếu khí không lên men lactose được đề cập trong bài hiện đang đối mặt với tình trạng đa kháng thuốc rộng rãi ở các cơ sở y tế. Trong đó, các khuyến cáo đều nêu rõ vai trò ưu tiên khi lựa chọn trimethoprim/sulfamethoxazol về tính nhạy cảm, có thể dùng đường uống và cân nhắc việc xuống thang khi đạt các tiêu chí ổn định lâm sàng sau thời gian dùng các kháng sinh phổ rộng trước đó. Đặc biệt, cần lưu ý đánh giá các yếu tố nguy cơ, đặc điểm lâm sàng và kết quả kháng sinh đồ cụ thể trên từng người bệnh, nhằm đảm bảo được tính hiệu quả, an toàn và hợp lý trong công tác điều trị.
Tài liệu tham khảo:
[1] Hannah K. Spencer et al, “An Overview of the Treatment of Less Common
Non–Lactose-Fermenting Gram-Negative Bacteria”, Pharmacotherapy, (2020), 40(9):936–951
[2] Iain J. Abbott, MBBS et al, “Stenotrophomonas, Achromobacter, and Nonmelioid Burkholderia Species: Antimicrobial Resistance and Therapeutic Strategies”, Semin Respir Crit Care Med, (2015), 36:99–110
[3] Jean Gibb, Darren W. Wong, “Systematic Review: Antimicrobial Treatment Strategies for Stenotrophomonas maltophilia: A Focus on Novel Therapies”, Antibiotics, (2021), 10, 1226
[4] Ma´rio´ Gajda´, Edit Urba´, “Prevalence and Antibiotic Resistance of Stenotrophomonas maltophilia in Respiratory Tract Samples: A 10-Year Epidemiological Snapshot”, Health Services Research and Managerial Epidemiology, (2019), 6: 1-9
[5] Yongwen Yang, Qun Yan, Xia Chen, Wenen Liu, Zijuan Jian, “Antibiotic Resistance Surveillance of Clinical Isolates of Stenotrophomonas maltophilia Strains in the Central South of China from 2016 to 2019”, Jundishapur J Microbiol., (2019), 12(11):e94647
[6] Alessio Strazzulla et al, “Trimethoprim-sulfamethoxazole as de-escalation in ventilator-associated pneumonia: a cohort study subanalysis”, European Journal of Clinical Microbiology & Infectious Diseases, (2021), 40:1511–1516
[7] Infectious Diseases Society of America, “Antimicrobial-Resistant Treatment Guidance: Gram-Negative Bacterial Infections. Infectious Diseases Society of America 2022; Version 2.0”, Truy cập ngày 31/05/2023, https://www.idsociety.org/practice-guideline/amr-guidance/
[8] Nemati et al, “Antimicrobial Susceptibility of Stenotrophomonas maltophilia Clinical Isolates from Blood Samples in Iran”, Journal of Medical Microbiology and Infectious Diseases, (2015), 3
[9] Said MS, Tirthani E, Lesho E., “Stenotrophomonas Maltophilia”, Truy cập ngày 19/04/2023, https://www.ncbi.nlm.nih.gov/books/NBK572123/
[10] Yan Jia et al, “Clinical characteristics, drug resistance and death risk factors of Burkholderia cepacia infection in hematopoietic stem cell transplant patients”, BMC Infectious Diseases, (2022), 22:777
[11] Häfliger E, Atkinson A, Marschall J., “Systematic review of healthcare-associated Burkholderia cepacia complex outbreaks: presentation, causes and outbreak control”, Infect Prev Pract., (2020), 2(3): 100082
[12] Lord R, Jones AM, Horsley A., “Antibiotic treatment for Burkholderia cepacia complex in people with cystic fibrosis experiencing a pulmonary exacerbation
”, Cochrane Database Syst Rev., (2020), 4(4):CD009529
[13] Kim KY et al, “Burkholderia Sepsis in Children as a Hospital-Acquired Infection”, Yonsei Med J., (2016), 57(1):97-102
[14] Tamma, Pranita. et al, “Successful Treatment of Persistent Burkholderia cepacia Complex Bacteremia with Ceftazidime-Avibactam”, Antimicrobial Agents and Chemotherapy, (2018), 62 (4), e02213-17
[15] Colin E. Swenson, Ruxana T. Sadikot, “Achromobacter Respiratory Infections”, Ann Am Thorac Soc, (2015), 12(2): pp 252–258
[16] Ulloa, Erlinda R. et al, “Azithromycin Exerts Bactericidal Activity and Enhances Innate Immune Mediated Killing of MDR Achromobacter xylosoxidans”, Infectious Microbes & Diseases, (2020), 2(1): pp 10-17
[17] Awadh H et al, “Pneumonia due to a Rare Pathogen: Achromobacter xylosoxidans, Subspecies denitrificans”, Case Rep Infect Dis., (2017), 2017:3969682
[18] Burcu Isler et al, “Achromobacter Infections and Treatment Options”, ASM Journals/Antimicrobial Agents and Chemotherapy, (2020), 64(11): e01025-20
[19] UpToDate, Stenotrophomonas maltophilia, Truy cập ngày 31/05/2023, https://www.uptodate.com/contents/stenotrophomonas-maltophilia
[20] Hall BC et al, “Standard vs High-dose Trimethoprim-Sulfamethoxazole for Stenotrophomonas maltophilia pneumonia”, Open Forum Infect Dis., (2020), 7(1):S747